Nature:淋巴结里的癌细胞,藏着个“保命开关”!
来源:生物谷原创 2025-11-10 10:36
转移到淋巴结的黑色素瘤细胞竟然依赖一种名为 FSP1的蛋白质来“续命”;更关键的是,他们已经找到了能阻断它的药物,为阻止癌症扩散带来了全新希望。
在全球范围内,黑色素瘤是恶性程度最高、转移能力最强的皮肤癌之一。据统计,晚期黑色素瘤患者的五年生存率仅为25%–30%,更可怕的是,其偏爱“兵分两路”,一路通过血液远走他乡,另一路则潜伏在淋巴结中,伺机而动。长期以来,科学家们一直在寻找能精准清除这些“潜伏者”的方法。
而最近,一篇发表在国际杂志Nature上题为“Lymph node environment drives FSP1 targetability in metastasizing melanoma”的研究报告中,来自哈佛大学陈曾熙公共卫生学院等机构的科学家们通过研究揭示了一个令人惊喜的发现:转移到淋巴结的黑色素瘤细胞竟然依赖一种名为 FSP1的蛋白质来“续命”;更关键的是,他们已经找到了能阻断它的药物,为阻止癌症扩散带来了全新希望。
如果把细胞比作一台精密机器,那细胞膜就像机器的外壳,当这台机器“生锈”,也就是细胞膜上的脂质被过度氧化时,细胞就会崩溃死亡;这个过程就是“铁死亡”。有趣的是,癌细胞虽然疯狂增殖,却也害怕这种“生锈式自杀”,为此,它们准备了多套“防锈系统”,其中最重要的两套,分别由GPX4和FSP1这两个蛋白质掌控。
为什么癌细胞在淋巴结中特别依赖FSP1?研究人员发现,淋巴结这个“微环境”有两个特点:1)缺氧:淋巴结中氧气浓度较低,导致GPX4蛋白不稳定,容易被降解;2)代谢重塑:癌细胞在淋巴结中减少了抗氧化物质谷胱甘肽的合成,转而依赖FSP1来抵抗铁死亡。换句话说,淋巴结就像是一个“特训营”,逼着癌细胞换了一套保命机制,从依赖GPX4转向依赖FSP1。
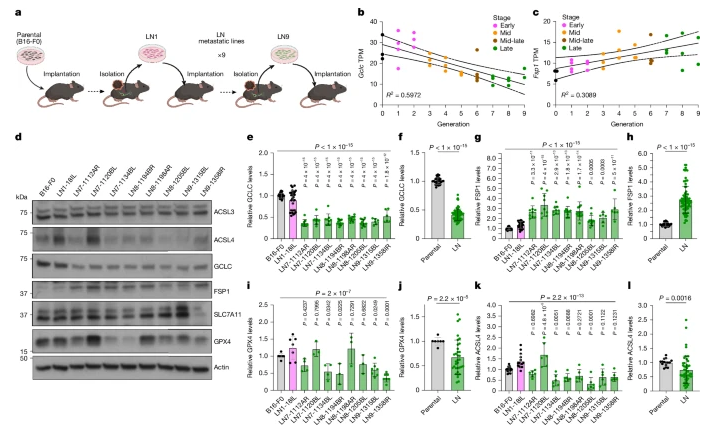
淋巴结转移细胞系呈现出FSP1表达升高,而GCLC、GPX4和ACSL4表达降低的特征。
这项研究中,研究人员有三大突破性发现:
(1)环境决定弱点: 研究人员发现,同样的黑色素瘤细胞,在皮下生长时并不依赖FSP1,但一旦转移到淋巴结就变得“离不开”它,这说明癌细胞的弱点会随着所处环境而改变。
(2)药物精准有效
研究人员使用两种新型FSP1抑制剂(viFSP1和FSEN1)直接注射到淋巴结肿瘤中,成功抑制了肿瘤生长;而在皮下肿瘤中,同样的药物效果甚微。
在同一期发表在Nature杂志上的另一项研究(doi:10.1038/s41586-025-09710-8)也证实,在肺癌中抑制FSP1同样能触发铁死亡;两篇论文相互印证,共同确立了FSP1作为广谱抗癌靶点的潜力。
过去大多数关于铁死亡的研究都是在培养皿中进行的,而这项研究选择在活体动物模型中探索癌细胞在真实环境中的行为。Mario Palma博士表示,转移性疾病才是大多数癌症患者的死因,但我们对其在淋巴结中的生存机制知之甚少,本文研究发现,淋巴结的微环境特征决定了黑色素瘤使用哪套抗氧化系统,这种环境特异性依赖此前未被充分认识。
这项研究不仅揭示了FSP1抑制剂的治疗潜力,更重要的是,其提醒我们,不应以同样的方式杀死每一个肿瘤细胞,而应该利用癌细胞在扩散过程中暴露出的弱点。该研究的意义远不止于发现一个新靶点,其揭示了一个更深刻的道理:癌细胞会“入乡随俗”,根据所处环境调整生存策略。这意味着,未来的癌症治疗可能需要“分场景施策”:对原发灶用一种药,对淋巴结转移灶用另一种药,对血行转移灶再用第三套方案;这种“精准分区治疗”思路有望大幅提高治疗效果同时减少副作用。
随着FSP1抑制剂的进一步优化和临床试验的推进,我们或许很快就能拥有一款专门清除淋巴结转移灶的“精准武器”,到那时,癌症治疗将不再只是“狂轰滥炸”,而是变成一场“精准围剿”,让原发肿瘤和转移灶各自“对号入座”,接受量身定制的死刑判决。(生物谷Bioon.com)
参考文献:
Palma, M., Chaufan, M., Breuer, C.B. et al. Lymph node environment drives FSP1 targetability in metastasizing melanoma. Nature (2025). doi:10.1038/s41586-025-09709-1
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


